
背景介绍:Severe Fever with Thrombocytopenia Syndrome Virus(SFTSV)发热伴血小板减少综合征病毒,属于布尼亚病毒科(Bunyavirales) 的白蛉病毒属(Bandavirus),是一种单股负链RNA病毒。主要通过蜱虫叮咬(如长角血蜱 Haemaphysalis longicornis) 传播,也可能通过接触患者血液/分泌物发生人际传播。由于缺乏特殊的抗SFTSV药物,存在全球性致死率高的风险。
布帕伐醌(Buparvaquone, BPQ)是第二代羟基萘醌类药物,作为一种用于治疗牛肠杆菌病的抗原虫药物上市。它代谢缓慢,半衰期长,毒性低,刺激性小,残留少,是一种安全的商业药物,用于兽医治疗。大量研究证明,BPQ对许多原生动物,如巴西芽孢杆菌、巴西孢子菌和贝斯诺提菌都有较强的抑制活性,也能抑制猴痘病毒等几种病毒的感染。但是对于BPQ的作用机制尚未完全阐明。
上海海军第十四军医大学海军医学院戚中田教授团队从FDA批准的1400个小分子中筛选出并确定BPQ是一种有效的SFTSV感染抑制剂;进一步的研究揭示了BPQ与病毒包膜糖蛋白Gc在病毒-宿主膜融合过程中相互作用的分子机制;并用小鼠感染模型和目标器官的iPSC衍生的器官中验证了其独特疗效,这代表着未来SFTSV治疗干预中潜在的有效和安全治疗选择。
预发表期刊:SSRN
样本类型:细胞模型、小鼠模型、类器官
研究手段:Lip-MS、DARTS、SPR、BLI、分子对接和分子动力学模拟,百泰派克提供Lip-MS及质谱检测。
研究结果:
1、筛选潜在的抗SFTSV化合物
利用优化的细胞感染模型,筛选了包含1400个小分子的FDA批准文库,在每个药物浓度为10 μM的条件下,评估其潜在的抗SFSV活性,并据此进一步阐明了优化化合物的抗病毒作用和机制(图1a)。
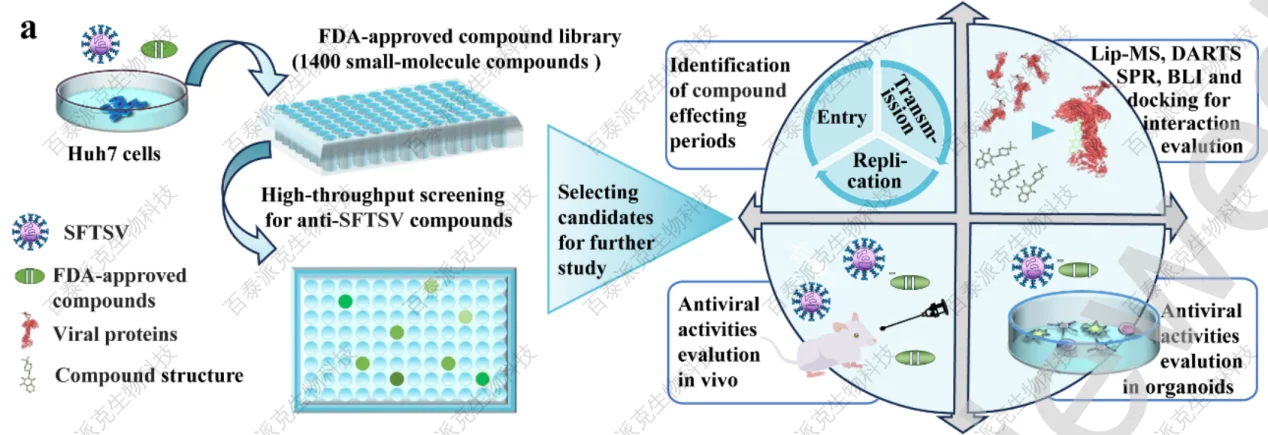
图1 FDA批准的抗SFTSV药物化合物文库的高通量筛选
初步筛选后,共有8个化合物在第二次平行筛选的中心浓度为10 μM时表现出较强的抗病毒活性(抑制率大于95%)(图1b)。其中BPQ在Huh7及THP-1、Vero和Raw264.7中表现出最佳的疗效和低细胞毒性(图1c-d)。
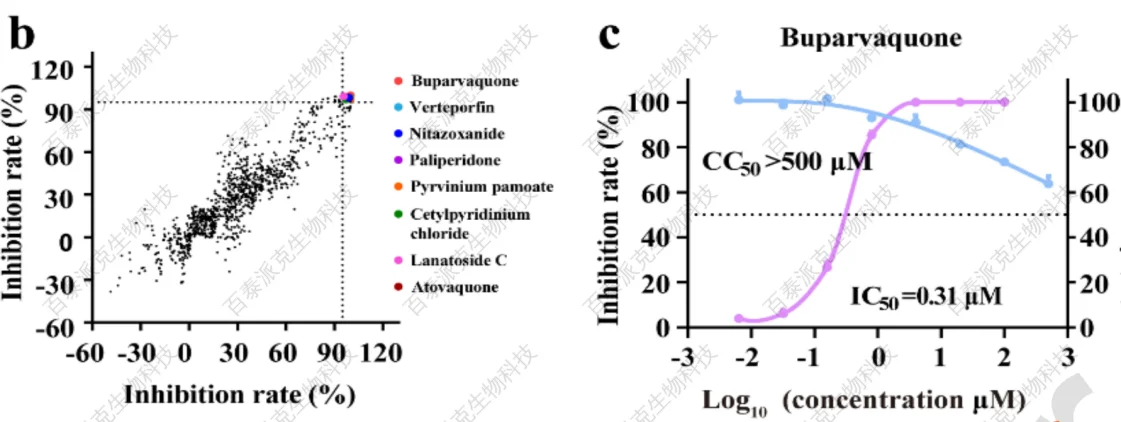
图1 BPQ表现出最佳的疗效和低细胞毒性
2、BPQ最有可能在内化后过程中抑制病毒进入
为了解BPQ对SFTSV的抗病毒作用,先设计了Huh7被病毒感染不同时间后受BPQ处理,结果表明,BPQ在0-4h内显著抑制SFTSV感染,尤其是在0-2小时(图2a)。之前研究表明,SFTSV的复制周期为5 h,因此推测BPQ可能在病毒感染的早期阶段,即病毒进入阶段,发挥抗病毒作用,并且发现0.08 μM BPQ处理对SFTSV几乎没有毒力(图2b)。
随后,检测了BPQ对病毒结合和内化(病毒粒子运输到细胞质中)的影响。文章将Huh7与SFTSV和BPQ或载体在4℃共孵育1.5 h,然后去除游离病毒颗粒,用RT-qPCR检测结合病毒,结果显示BPQ不影响SFTSV结合过程(图2c);之前研究表明SFTSV通过网格蛋白介导的内吞途径内化,这与文章结果一致,即在网格蛋白介导的内吞作用抑制剂pitstop 2 (PP2)存在时,SFTSV感染被抑制,而不是小窝介导的内吞作用或Filipin III或amiloride的微胞吞作用抑制剂(图2d),为了确定BPQ是否阻碍SFTSV内化,本实验使用荧光标记转铁蛋白(TF,由网格蛋白介导的内吞作用内化的经典分子),结果表明BPQ处理没有改变TF的摄取,而PP2显著降低细胞内荧光标记的TF,表明BPQ也没有阻碍SFTSV内化(图2e)。
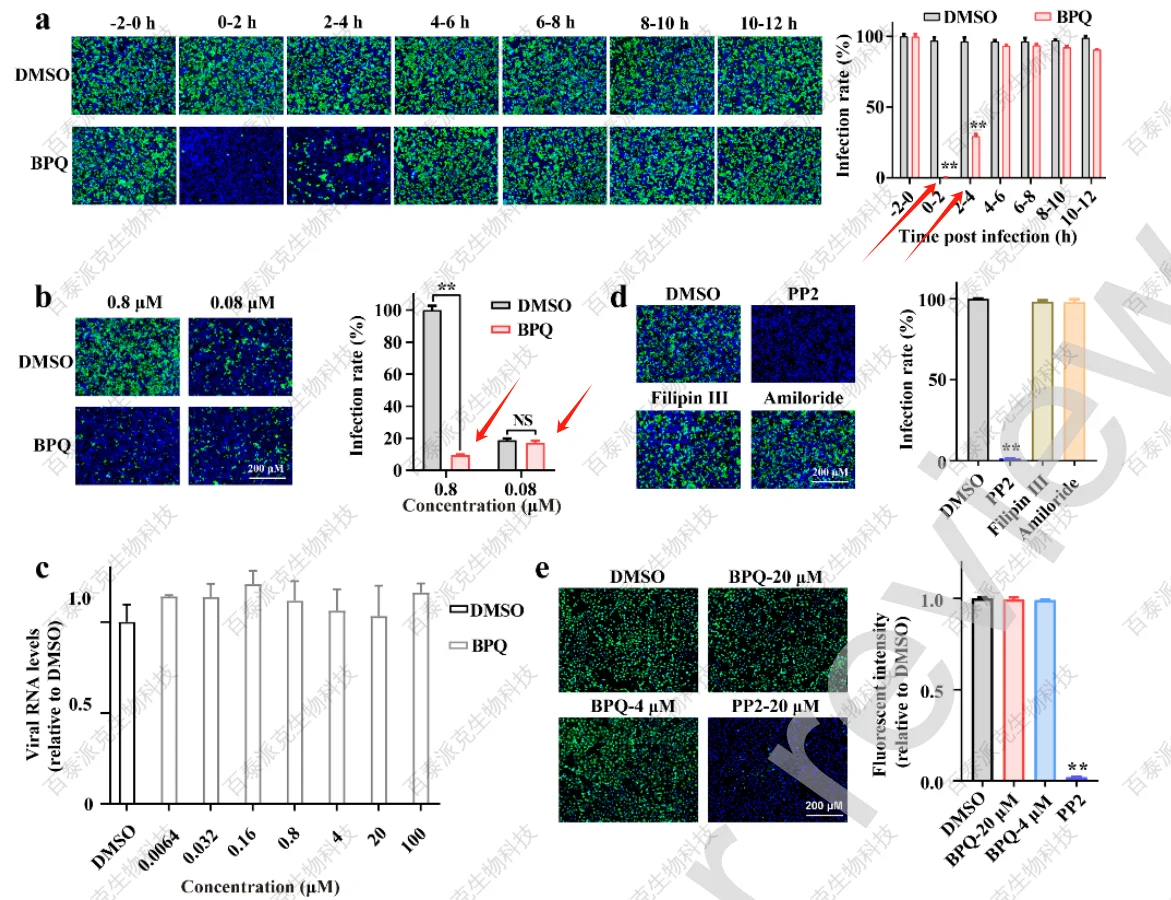
图2 BPQ对SFTSV侵袭早期的影响
3、BPQ干扰病毒膜融合过程,但不影响内体酸化
在病毒内化之后,SFTSV启动了膜融合过程。文章评估了BPQ对病毒膜融合的影响。先进行了动力学试验,以确定BPQ的抑制模式:分别用BPQ、bafilomycin A1、NH4Cl对感染的Huh7进行不同时间的处理,BPQ表现出与bafilomycin A1和NH4Cl等公认的膜融合抑制剂相似的抑制模式,并且仅在病毒感染的初始阶段发挥抗病毒活性,提示BPQ可能抑制病毒膜融合(图3a)。
后面利用DiO标记的SFTSV (SFTSVDiO)实时监测病毒-宿主细胞融合。荧光强度的增加的现象定义为膜融合,这是由于病毒粒子-宿主膜融合过程中DiO的稀释而引起的猝灭。BPQ处理组与bafilomycin A1和NH4CI相比,荧光强度有明显甚至更显著的降低(图3b-c)。由于膜融合的最后一步是融合孔的形成和内体RNA的释放,文章也研究了BPQ是否对它们有影响。用不同的化合物处理SFTSV感染的Huh7,然后用冷PBS和高盐、高ph缓冲液彻底清洗,使用洋地黄苷对细胞进行渗透,使细胞质成分(包含经过完全膜融合的病毒释放的RNA)扩散到细胞质溶胶中,收集并检测细胞质和膜组分,通过WB分析评估细胞质和细胞膜分离效率,其中GAPD和Rab7分别代表细胞质和膜组分(图3d)。结果显示,与膜融合抑制剂一致,BPQ显著降低了胞内体释放的细胞质病毒RNA水平(图3e)。
研究证实,SFTSV 膜融合过程以pH依赖的方式发生在核内体晚期,其中pH必须降低到约5.6才能触发病毒糖蛋白重塑,暴露Gc蛋白融合环的活性位点。因此,文章检测了BPQ对内体酸化的影响。将SFTSV 感染的Huh7与化合物在37℃下孵育2 h,然后将上清替换为含有Lysotracker Deep Red试剂的新鲜培养基,以促进细胞酸性细胞器的可视化。与bafilomycin A1和NH4Cl相比,BPQ和空白对照组的荧光强度无明显差异(图3f),表明BPQ不影响内体酸化。
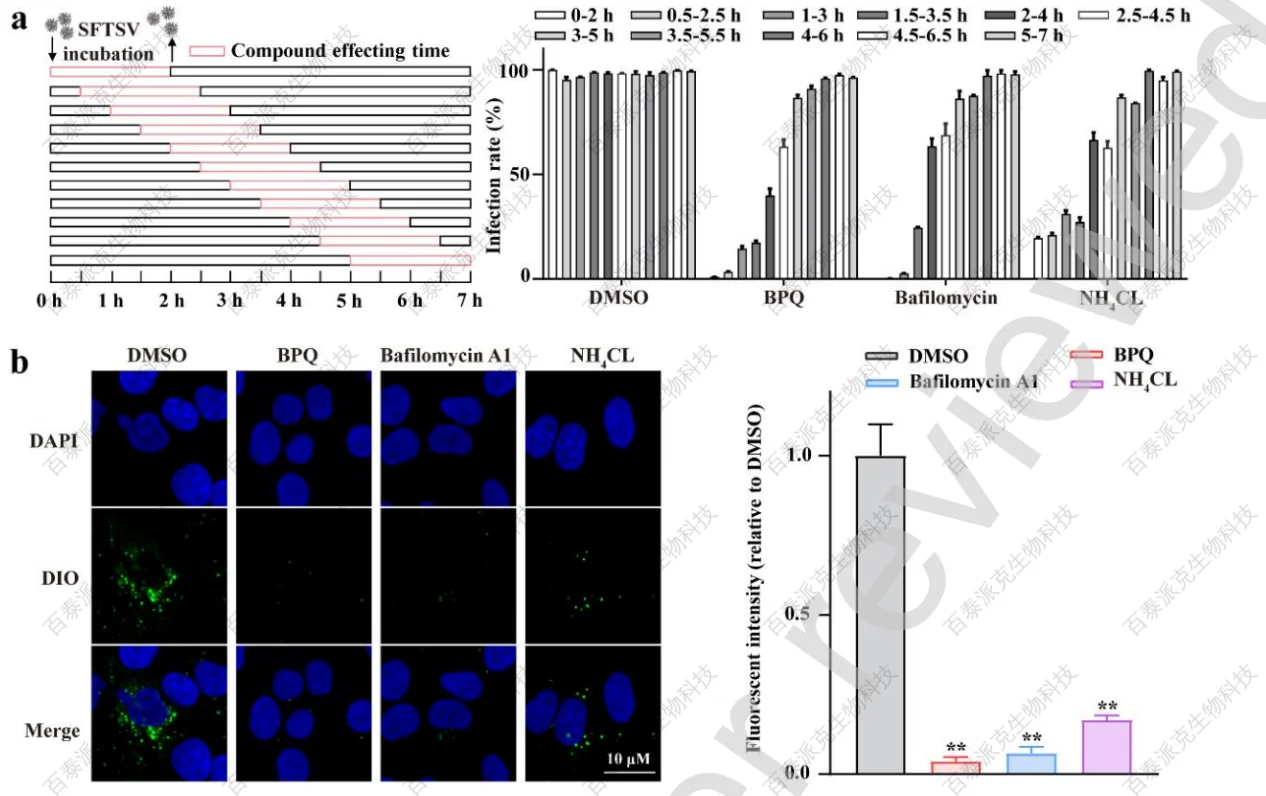
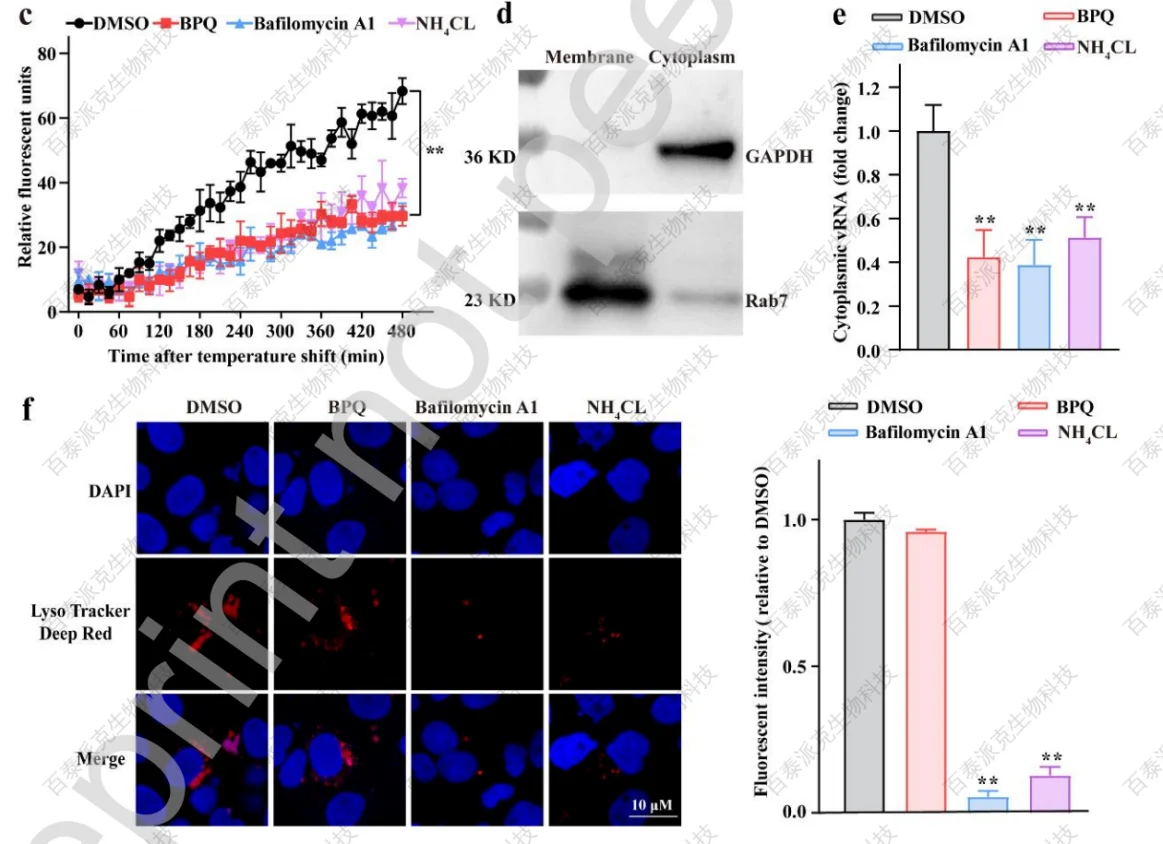
图3 BPQ受损的SFTSV膜融合过程
4、大规模筛选与BPQ相互作用的靶蛋白-Lip-MS
为了阐明BPQ抑制SFTSV膜融合的具体机制,文章用SFTSV感染的Huh7裂解液与指定浓度的BPQ孵育,用Lip-MS筛选与BPQ相互作用的蛋白(图4a)。与对照组相比,4 μM BPQ处理组共鉴定出2067个上调和1469个下调的DQPs,40 μM BPQ处理组鉴定出2171个上调和1425个下调的DQPs。然后根据BPQ浓度,采用分层聚类法分析DQP的定量变化(图4c)。
DPQs的表达模式被分为4个簇,其中簇2和簇4的特征为增加模式,因为与对照组相比,在指定浓度的BPQ下,暴露肽的数量增加,这表明该化合物覆盖了更多相关肽,保护它们免受蛋白酶裂解(图4d)。最重要的是,4 μM BPQ处理组中有5个肽段和40 μM BPQ处理组中有3个肽段来自SFTSV Gc蛋白,该蛋白是SFTSV膜融合的关键病毒蛋白。此外,这5个多肽都在上调的暴露肽中(图4b),其中2个遵循簇4模式。结合前期BPQ抑制SFTSV膜融合过程的结果,推测BPQ可能通过与病毒Gc蛋白相互作用抑制病毒感染。
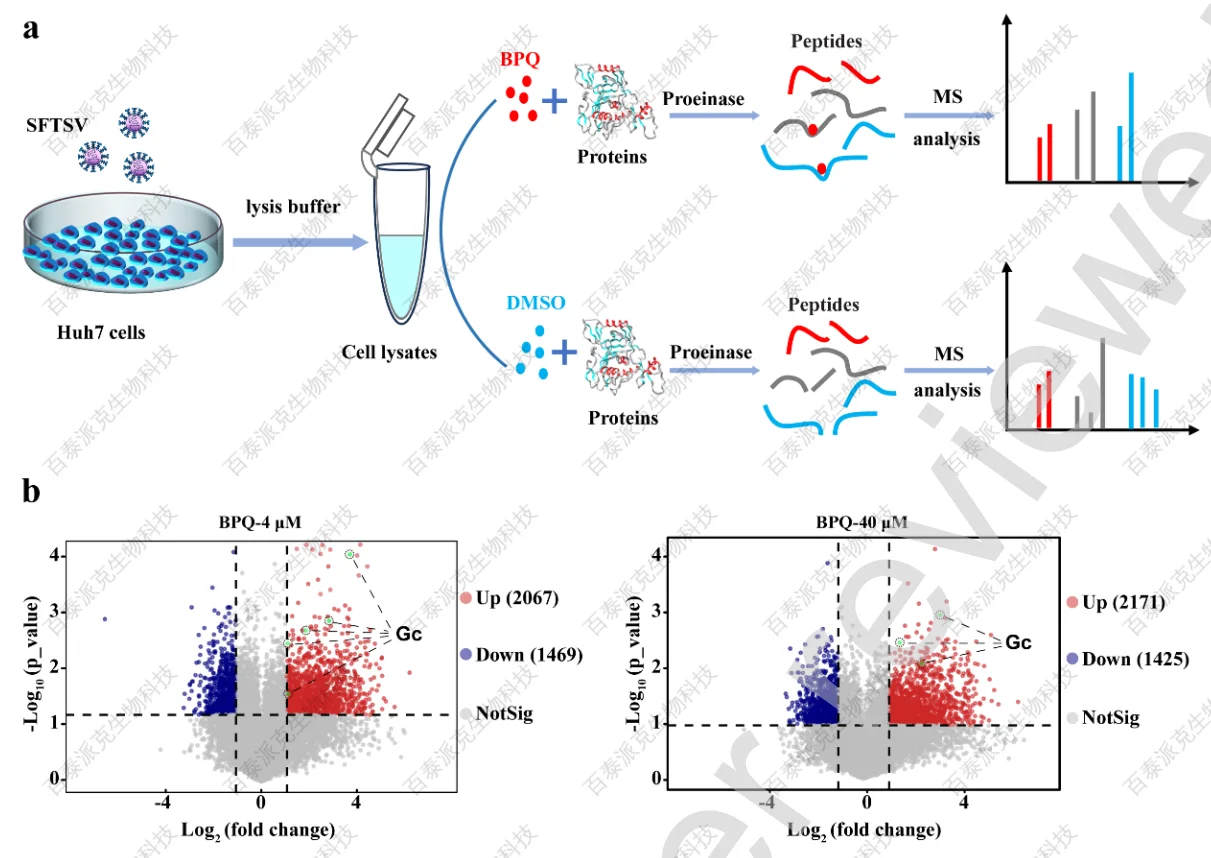
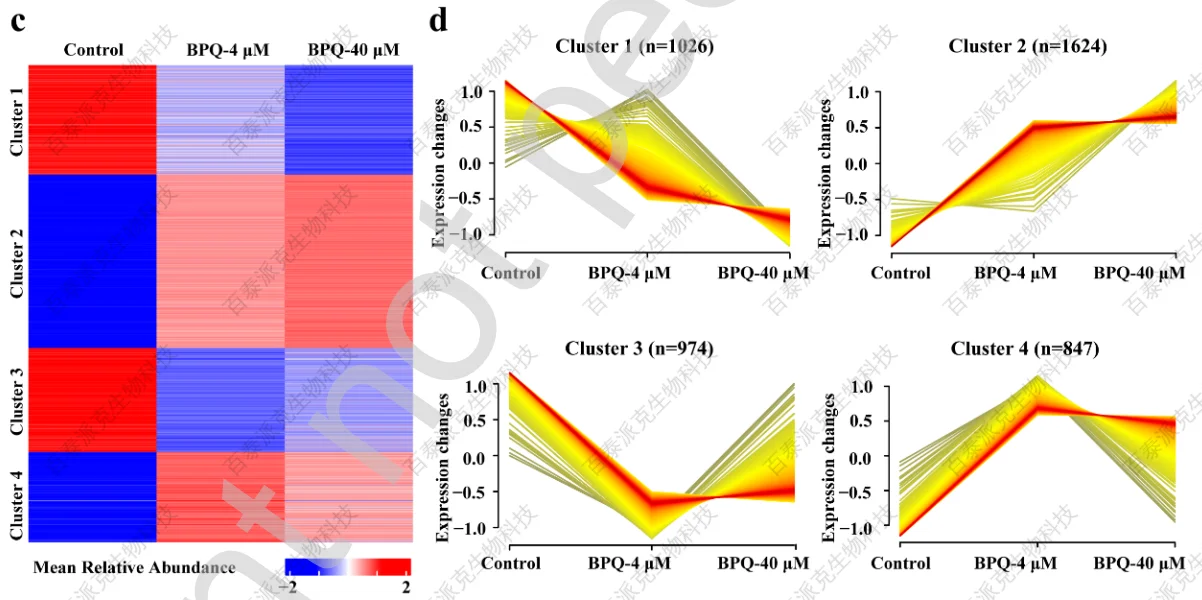
图4 Lip-MS分析大规模筛选与BPQ相互作用的靶蛋白
5、BPQ通过与病毒Gc直接相互作用抑制SFTSV膜融合过程
为了验证BPQ和Gc蛋白之间的潜在相互作用,文章进行了药物亲和力响应靶稳定性(dart)测定。结果显示,BPQ显著抑制pronase对病毒Gc蛋白的蛋白水解,且呈剂量依赖性,提示BPQ可能与Gc结合(图5a)。更重要的是,通过表面等离子体共振(SPR)和生物层干涉法(BLI)测定化合物与靶蛋白的结合亲和力,均表明BPQ和Gc蛋白之间存在较强的直接相互作用。
分子对接推测BPQ与Gc蛋白之间潜在的相互作用。三维结构模型表明,BPQ能够渗透到蛋白口袋内部,并与Gc II结构域的氨基酸残基形成广泛的相互作用(图5e)。BPQ与蛋白质的结合能和对接分数分别为-56.26 kcal/mol和-7.186,表明有较强的相互作用。在Lip-MS检测中,一个上调的DQP(K631-R641)(图5e所示的粉色肽)位于BPQ- Gc binding区域,形成疏水相互作用和静电相互作用(图5e)。结构域II对于Gc的生物学功能至关重要,因为它包含负责介导膜融合的融合环。通过分子动力学模拟(MDS)技术进一步评价了BPQ与Gc的结合相对稳定。
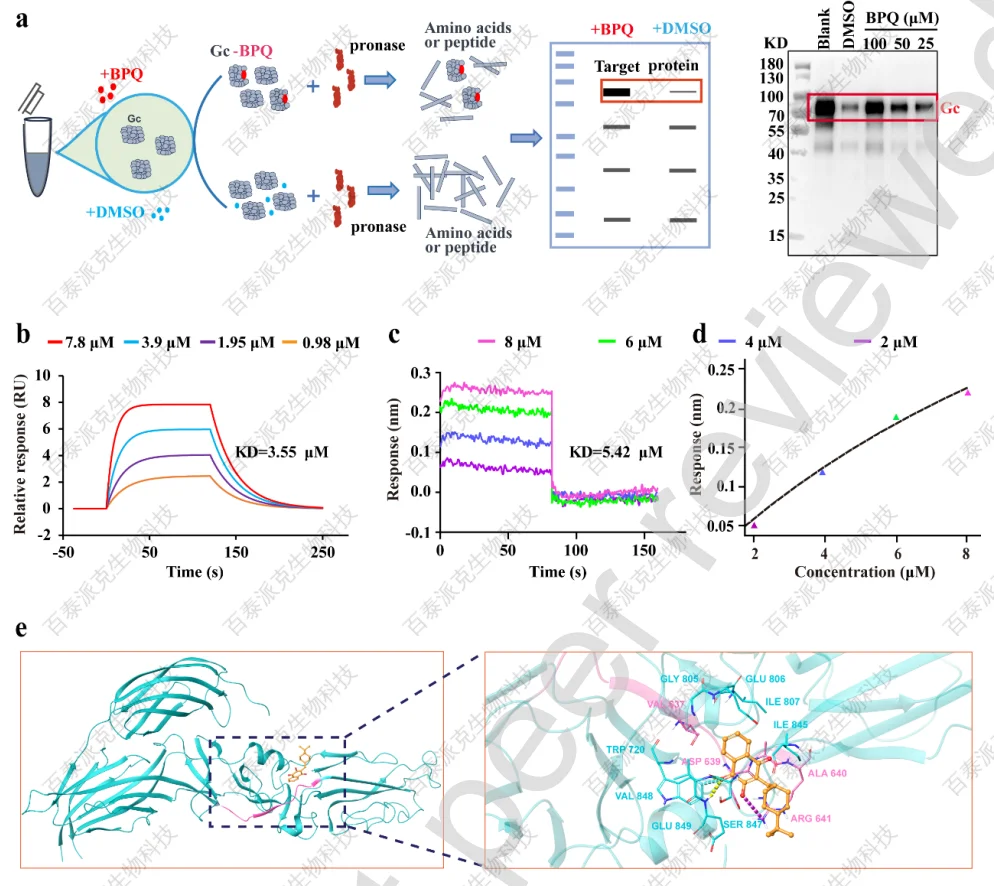
图5 BPQ与病毒Gc蛋白的相互作用
6、BPQ在体内对SFTSV全身感染具有保护作用
文章对BPQ的体内抗病毒活性也进行了评价。文章采用干扰素受体缺陷型(A129-/-)小鼠模型(该模型是经验证的致死性SFTSV感染模型)。结果显示,感染前24 h用BPQ处理小鼠,存活率提高了约30%(图6a),存活小鼠的体重均逐渐恢复到正常水平(图6b)。BPQ治疗还显著缓解了疾病发展早期的血小板减少症(图6c),这是SFTSV严重程度的关键指标。此外,BPQ治疗后,在整个感染过程中,脾脏、肝脏、结肠等靶器官的病毒载量也显著降低(图6d、图6e、图6f)。同样,免疫荧光也证实了脾脏SFTSV感染的减少(图6g),组织病理学分析显示BPQ处理小鼠的病理损伤较轻,脾脏白色髓萎缩减轻(图6h)。
文章也用C57BL/6小鼠模型评估了BPQ的保护作用。C57BL/6小鼠在疾病早期表现出典型的血小板减少和SFTSV器官感染的临床症状。BPQ处理减轻了感染小鼠的血小板减少(图6i)的情况;脾脏的病毒载量和蛋白表达(图6j和图6k)也减少;通过组织病理学分析,脾脏出现了较轻的病理性损伤(图6l)。结果表明BPQ在体内对SFTSV感染具有一定的保护作用。
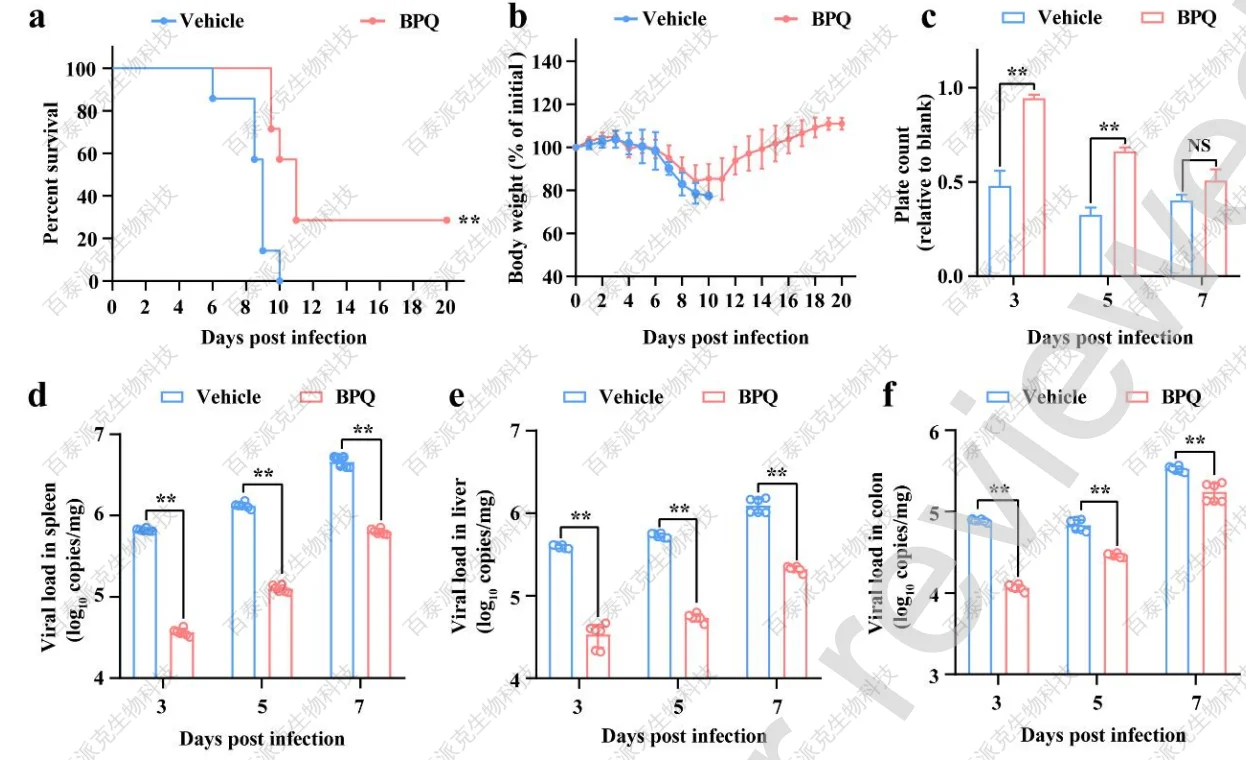
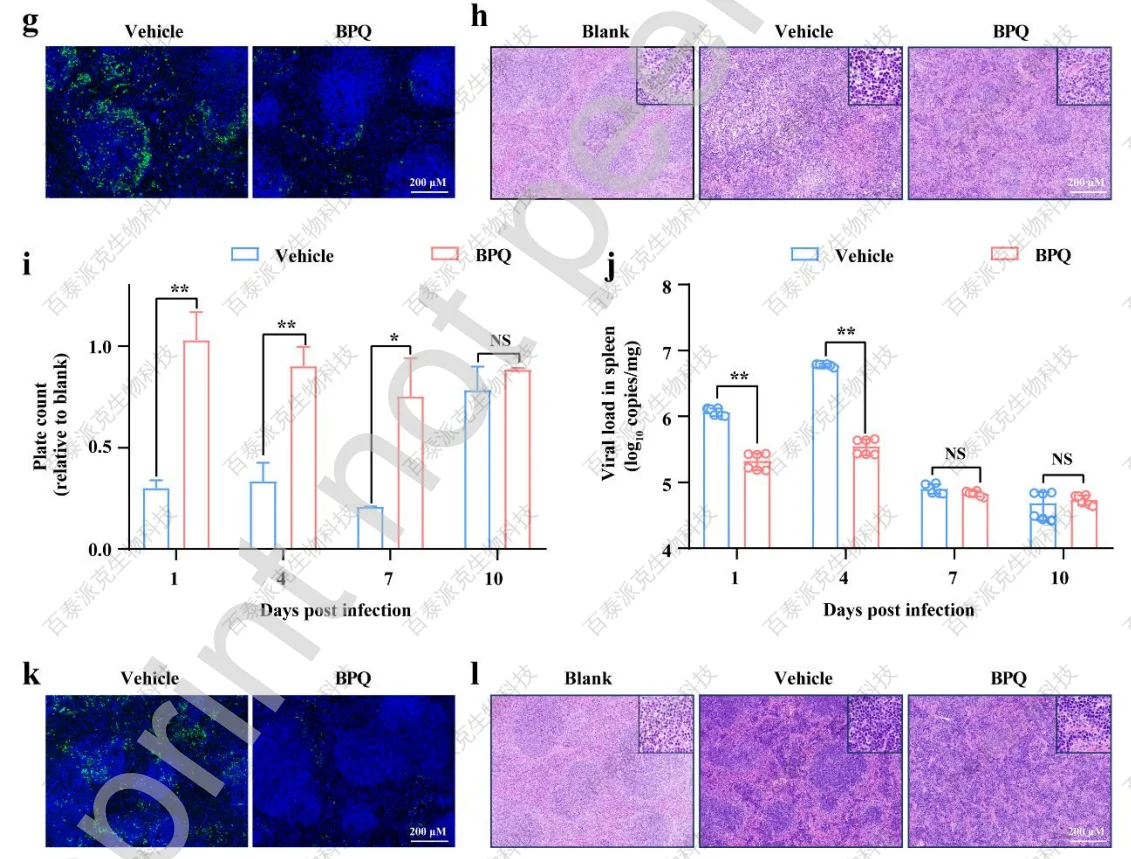
图6 BPQ在SFTSV感染的A129−/−和C57BL/6小鼠中的表现出抗病毒活性
7、BPQ对人类来源的肝脏和结肠类器官具有有效的抗病毒活性
文章将成熟且质量合格的肝脏和结肠类器官在指定浓度的BPQ存在下37℃用SFTSV孵育24小时,后回收类器官,采用全挂载免疫荧光染色法检测病毒核蛋白(NP)的感染情况。结果表明,BPQ在成熟的人肝脏类器官中以剂量依赖的方式抑制SFTSV感染,这一点通过检测白蛋白(ALB)水平得到证实(图7a)。BPQ浓度为4 μM时,对结肠类器官的抗病毒作用更为明显,几乎检测不到病毒NP;结肠特异性标记物SATB2在感染后大量减少,提示病毒与宿主因子之间可能存在相互作用(图7b)。
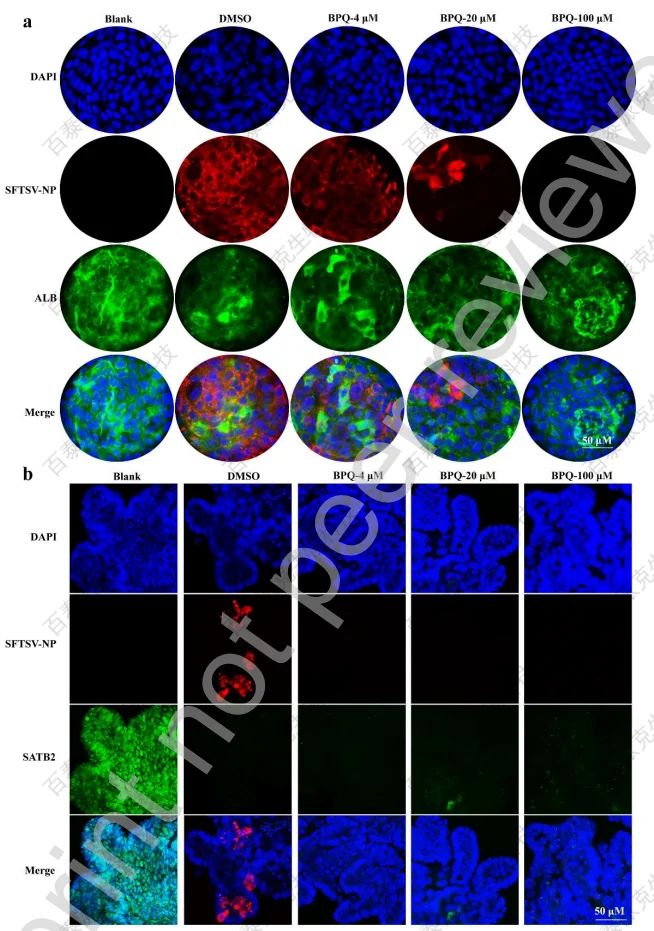
图7 BPQ在SFTSV感染的人iPSC衍生的肝脏和结肠类器官中的抗病毒活性
研究结论:
SFTSV感染的新出现和不断上升的发病率促使开发新型有效、安全的抗SFTSV药物。在本研究中,首次发现抗寄生虫药物BPQ具有低毒性、高抗病毒活性。体外实验表明,BPQ通过与病毒Gc蛋白直接相互作用抑制SFTSV感染,从而干扰病毒进入期的膜融合过程。BPQ对感染小鼠也表现出最佳的保护作用,可使免疫缺陷小鼠的存活率提高约30%并观察到BPQ对人类iPSC衍生的肝脏和结肠类器官病毒感染的抑制效果令人满意,显示出良好的临床应用前景。
百泰派克生物科技--致力于为您提供优质的生物质谱分析服务
关于我们
北京百泰派克生物科技有限公司致力于为生物/制药和医疗器械行业提供质量控制检测和项目验证等专业服务。公司实验室遵循NMPA、ICH、FDA和EMA等的法规和指导原则,通过CNAS/ISO9001双重质量体系认证,建立了完备的质量体系,数据冷热/异地备份,设备定期计量/期间核查,软件审计追踪,为客户提供一体化解决方案和技术服务,支持新药研发、药物申报注册和生产放行。
1.公司采用ISO9001质量控制体系,专业提供以质谱为基础的CRO检测分析服务;
2.获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务;
3.业务范围覆盖蛋白质组学、多肽组学、代谢组学、生物药物表征、单细胞分析、单细胞质谱流式、生信云分析以及多组学生物质谱整合分析等;
4.七大质量控制检测平台,满足您一站式服务需求;
5.服务3000+企业,10000+客户的选择;
6.致力于为您提供优质的生物质谱分析服务!
